高認化学の過去問
物質の変化について、問3~6に答えよ
解答 ④
解説
中和滴定に用いる指示薬であるフェノールフタレインの変色域はpH8.0~9.8(※参考文献 実教出版 化学基礎 p134 指示薬と変色域)であり、pH8.0付近で溶液の色が無色からうすい赤色へと変色し、pHの上昇とともに赤色が濃くなっていく。したがって、水に溶解させた場合に塩基性を示す中性塩を選べばよい。塩の液性は中和反応に用いられる酸・塩基の強弱によって決まるので①は強酸である塩酸HClと強塩基である水酸化ナトリウムNaOHの塩であるので水に溶解させると中性、②は強酸である硫酸H2SO4と弱塩基であるアンモニアNH3の塩であるので水に溶解させると酸性、③は強酸である塩酸HClと弱塩基であるアンモニアNH3の塩であるので水に溶解させると酸性、④は弱酸である酢酸CH3COOHと強塩基である水酸化ナトリウムNaOHの塩であるので水に溶解させると塩基性、⑤は、強酸である硫酸H2SO4と強塩基である水酸化カリウムKOHの塩であるので水に溶解させると中性を示す。したがって、答えは④である。
これだけは押さえよう!!
<中和滴定に用いる指示薬>
強酸と強塩基の中和 ⇒ フェノールフタレイン(変色域pH8.0~9.8)、メチルオレンジ(変色域pH3.1~4.1)、ブロモチモールブルー(変色域pH6.0~7.6)のどれを用いてもよい
強酸と弱塩基の中和 ⇒ メチルオレンジ(変色域pH3.1~4.1)が適当
弱酸と強塩基の中和 ⇒ フェノールフタレイン(変色域pH8.0~9.8)が適当
弱酸と弱塩基の中和 ⇒ 中和点付近のpHの変化が小さいため、指示薬による判定は難しい
<中和反応により生じた塩の液性>
中和反応により生じた塩の液性 ⇒ 中和反応に用いられた酸・塩基の強弱によって決まる(強いほうの性質が現れる)
・強酸 + 強塩基 ⇒ 水に溶解させると塩は中性を示す
・強酸 + 弱塩基 ⇒ 水に溶解させると塩は酸性を示す
・弱酸 + 強塩基 ⇒ 水に溶解させると塩は塩基性を示す
・弱酸 + 弱塩基 ⇒ 水に溶解させると塩は中性を示す
解説
解答 ②

である。したがって、酸化数が減少しているのは⑥であるので答えは⑥となる。
これだけは押さえよう!!
解説
解答 ①
ダニエル電池は負極として用いる亜鉛板を硫酸亜鉛ZnSO4水溶液に浸し、正極として用いる銅版を硫酸銅(Ⅱ)CuSO4水溶液に浸して2種類の溶液をイオンが通過できる素焼き板で仕切り極板を銅線でつないだ電池である。電池ではイオン化傾向の大きな金属が負極となりで負極では酸化反応が起こる。一方、イオン化傾向の小さな金属は正極となり正極では還元反応が起こる。ダニエル電池では亜鉛Znと銅Cuが極板に用いられているが銅Cuよりも亜鉛Znの方がイオン化傾向が大きいので亜鉛Znが負極、銅Cuが正極となる。また、両極では以下のような反応が起こる。
(正極)Cu2+ + 2e- → Cu …還元反応
(負極)Zn → Zn2+ + 2e- …酸化反応
したがって、電子は亜鉛Zn極板から銅Cu極板に流れ、正極である銅Cuの極板には銅が析出する。また、素焼き板をガラス板に変えると起電力が低下する。これは両極板で起こる酸化還元反応に伴い両極板の水溶液中の亜鉛(Ⅱ)イオンZn2+と硫酸イオンSO42-に偏りが生じるからである。これを防ぐため、イオンが自由に移動できる小さな孔(あな)のあいた素焼き板が両極の水溶液の仕切りとして用いられている。したがって答えは①である。
これだけは押さえよう!!
電池…酸化還元反応によって生じるエネルギーを電気エネルギーとして取り出す装置
電池ではイオン化傾向の大きな方が負極(酸化反応が起こる)、イオン化傾向の小さな方が正極(還元反応が起こる)となる。
ダニエル電池 (-)Zn|ZnSO4aq|CuSO4aq|Cu(+)
[負極] Zn
Zn → Zn2+ + 2e-
[正極] Cu
Cu2+ + 2e- → Cu
(特徴)分極を生じない
⇒イオンが自由に移動できる素焼き板によって両極で生じるイオン(負極では亜鉛(Ⅱ)イオンZn2+、正極では硫酸イオンSO42-)の偏りを防ぐため
解説
解答 ③
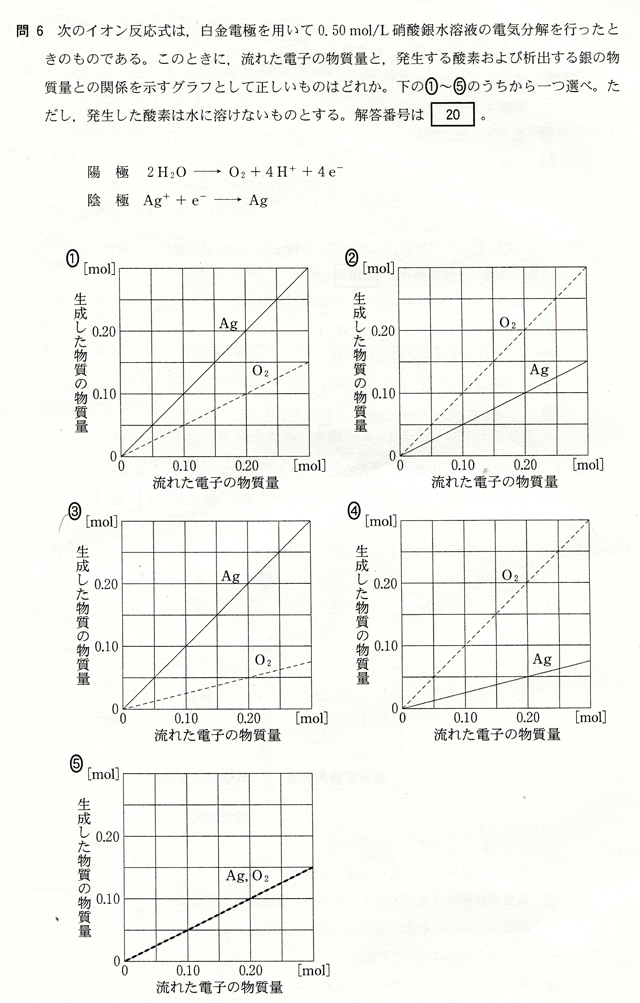
イオン反応式より陽極では流れた電子の物質量の1/4の物質量だけ酸素O2が発生し、陰極では流れた電子と同じ物質量の銀Agが析出する。また、陽極で発生する酸素O2の物質量と陰極で析出する銀Agの物質量の量的関係は陰極のイオン式の両辺を4倍して両極で流れた電子の物質量と等しくすると
陽極:2H2O → O2 + 4H+ + 4e-
陰極:4Ag+ + e- → 4Ag
となるので陽極で発生する酸素O2の4倍の物質量の銀Agが陰極で析出する。したがってこれらの条件を満たすグラフを選ぶと答えは③となる。
これだけは押さえよう!!
電気分解…電池が生み出す電気エネルギーの力を借りて極めて起こりにくい酸化還元反応を起こすこと電気分解ではイオン化傾向の大きな方が陽極(酸化反応を無理やり起こす)、イオン化傾向の小さな方が陰極(還元反応を無理やり起こす)となる。
陽極では電解質溶液や極板に含まれる元素やイオンの種類に応じて、優先順位の高い方から順に
・金属が陽イオンになる
・ハロゲン化物イオンが単体になる
・水酸化物イオンが酸素になる
の反応が、陰極では電解質溶液や極板に含まれる元素やイオンの種類に応じて、水素を発生させるかあるいは金属の単体の析出を起こす。


山田 花子 20歳
ある事情があり、高校を受験せず中卒のまま派遣に登録。今は工場で勤めている。
看護の専門学校に行き看護師になるのが夢。趣味はマン喫に行くこと。
好きな言葉:根性

山崎 太郎 22歳
中学から不登校気味だった。高校で再起をはかろうと工業高校に入学するもまた不登校になり2年で中退。同じ年の人が就職や結婚が増えてきて自分もそろそろ正社員になろうと思い仕事を探している。学力は中学数学は全く分からない(汗)趣味はプレステ
好きな言葉:どうにかなる

川崎 健太 16歳
この中では1番若い。全日制に在籍(休学中)。高卒認定の事を友達から聞き大学や専門学校に行ける事を考えると高校に行くより18歳まで自分の好きな事をやっておきたいと思い休学している。趣味はスマホ。
好きな言葉:スマホは命より大事